想要发现自然界的基本定律,证明每种元素都服从这样的定律,并且可依据这个定律推导出元素的性质。这不仅需要天才的直觉,还需要坚持不懈、永不言弃的精神。这件事情只有门捷列夫做到了。他想出了自然界全部元素的相互关系,把元素有条不紊地整理了出来,发现了自然界的新定律——化学元素周期律。
门捷列夫元素周期表

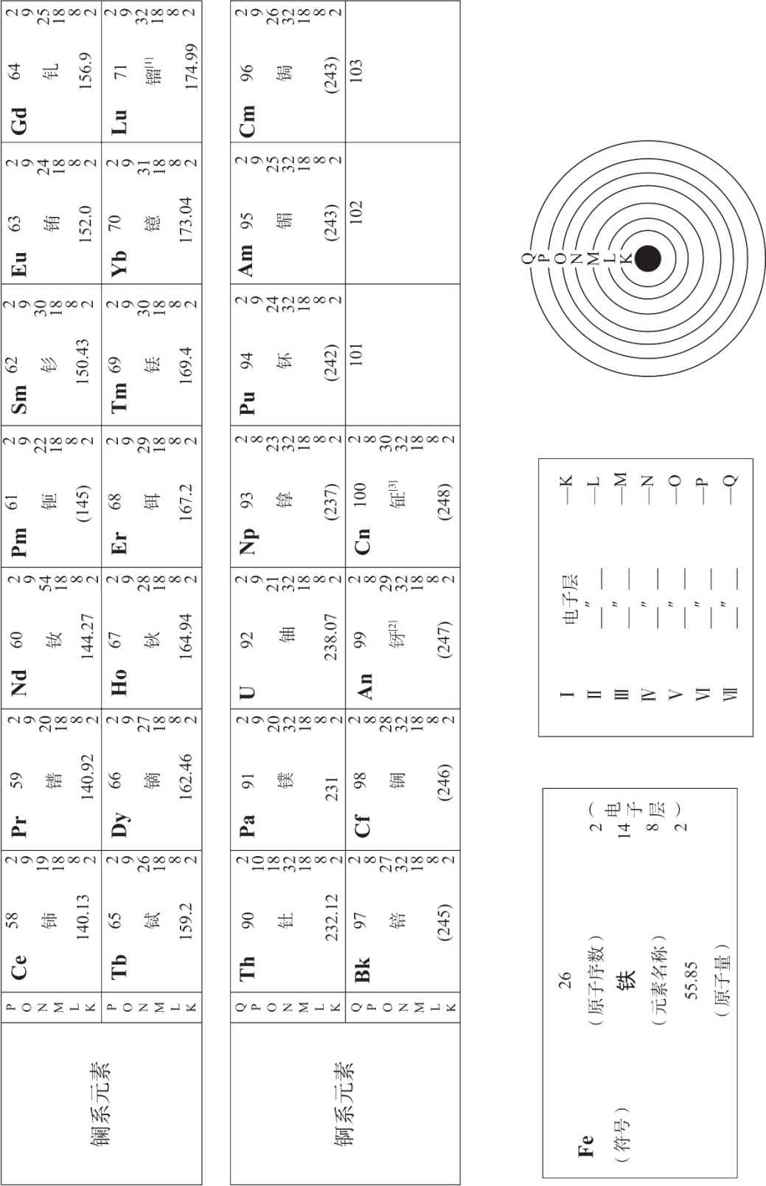
门捷列夫在周期律上用了40年的工夫,在实验室里追寻化学的秘密至最深奥之处。后来,他进入度量衡检定局,用当时最精密的实验仪器研究测定金属的物化性质,得到的结果更加证实了周期律的正确性。他还到乌拉尔研究石油的起源,发现的结构也证实了周期律。门捷列夫临死前,把1869年排好的元素表一再修正,让后来的化学家们在他的周期表的指引下不断补充新元素,最终变成了我们现在所见到的门捷列夫元素周期表。
之后,科学家们发现门捷列夫周期表对于研究原子结构的规律性也是很好的指南。1913年英国物理学家华莫斯莱在研究元素光谱时,无意中发现元素表的另一个规律性,那就是原子的核电荷数等于元素的原子序数,而且原子核外的电子个数也等于原子序数。那些电子被原子核吸引在周围,顺着轨道旋转。比如,锂的原子序数是3,它的核电荷数是3,核外也有3个电子。
任意一个原子,它的全部电子都是按照一定的分布方式排布在原子核外的。离核最近的第一层K层上,除了氢是一个电子外,其他元素都排布了2个电子。第二层L层上,最多能排8个电子。第三层M层最多,是18个。第四层N层是32个。
最外层电子结构决定了原子的化学性质。如果最外层电子数是8,那么这个原子是非常稳定的。如果最外层是一两个电子,那么这个原子是非常容易失去这一两个电子的,失去之后,原子就变成了离子。比如,钠、钾、铷最外层是1个电子,它们就非常容易失去这个电子变成带正电的一价正离子。这时倒数第二层变成了最外层,这层有8个电子,所以离子很稳定不会再起变化。
镁、钙、锶和其他碱土金属原子,最外层是两个电子。它们失去这两个电子后就变成了稳定的二价正离子。氟、氯、溴和其他卤素原子,最外层电子数是7,它们非常想再夺过来一个电子,这样最外层就补够了8个电子变成一价负离子。
如果原子最外层是3、4或5个电子时,这些元素变成离子的趋势就不是很明显了。
原子核结构决定了这种元素的原子量和在自然界里的分布含量。而原子的核外电子数则决定了元素的化学性质和光谱情况。自从发现了这些规律,世界上所有的科学家都明白了门捷列夫的元素周期律是自然界最奥妙的规律之一。
相关知识:纽兰兹(1837~1898年),英国分析化学家、工业化学家,在门捷列夫之前发现并研究了化学元素性质的周期性。
