你可能会这么想,那么多的分子都在1立方厘米中,它们不挤吗?是的,不挤。氧分子或氮分子的直径大概是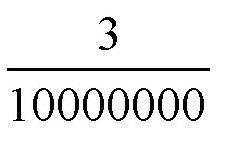
(即3×10-7)毫米。如果我们把分子直径的立方当成它的体积,就是:
(3×10 -7 )3 = 27×10-21立方毫米
而在1立方厘米中,一共有27×1018个分子,所以,这些分子所占的体积是:
27×10-21×27×1018 = 729×10-3立方毫米
大概是1立方毫米,相当于1立方厘米的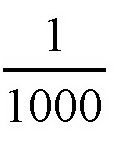
。也就是说,跟分子的直径相比,这些分子之间的空隙要大多了。所以,这些分子可以在这里面随意运动。实际上,我们知道,空气中的分子并不是静止不动的,更不是堆成一堆的,它无时无刻不在运动,从一个地方到另一个地方不停地运动着。
在工业上,经常要用到氧气、二氧化碳、氢气、氮气等气体。但是,要想大量保存它们,就需要非常大的容器。比如说,在正常气压下,1吨(1000千克)氮气的体积是800立方米,也就是说,保存1吨氮气需要800立方米容器的容量。如果是1吨氢气,需要的容器容量是10000立方米。
工程师们想了一个办法,把它们的分子进行挤压,也就是压缩这些气体,使它们排得紧密一些。但是,这在实际操作过程中却不是一件简单的事情。我们知道,当我们向气体施压的时候,它也会反作用力于容器壁。所以,这就要求非常坚固的容器,并且不会被里面所装的气体腐蚀。
于是,人们想到了合金钢这种材料制成的化学器皿可以承受很大的压力和很高的温度,并且不会跟气体发生化学反应。
现在,我们已经可以把氢气压缩到原来体积的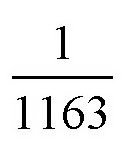
。也就是说,在正常气压下,1吨氢气所占体积是10000立方米,而在如 图 中,它只需要大概9立方米容积的钢筒就可以了。
我们可以思考一下,这时候,钢筒里氢气的体积缩小到了原来的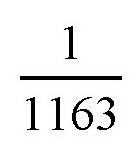
,那它受到的压力有多大?
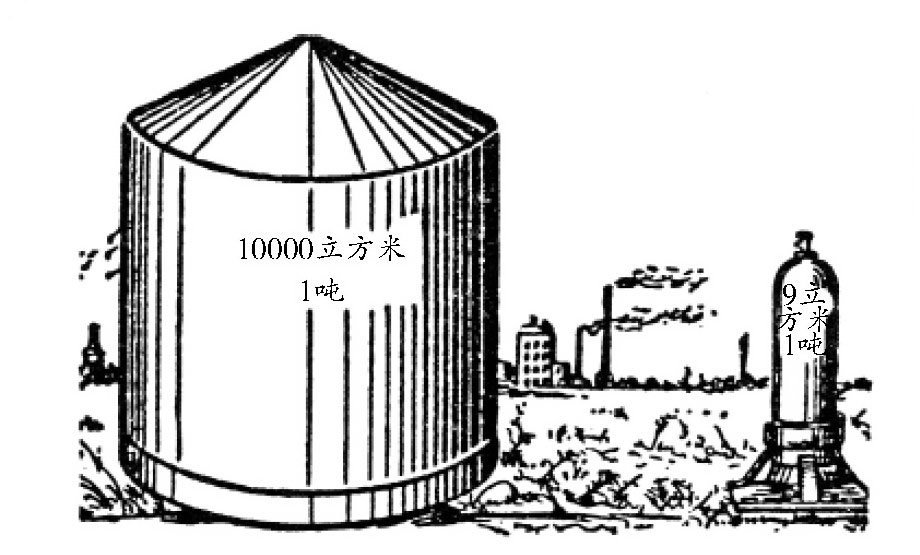
图 左图:一吨重的氢气,在大气压力下所占的体积。右图:它在5000气压下所占的体积。(图中比例仅供参考)。
在物理学上,气体的体积要缩小到原来的多少分之一,压力就会增加到原来的多少倍,所以我们马上就可以得出,它所受到的压力增加到了原来的1163倍。真实情况是这样的吗?当然不是,实际上,这时候筒里面的氢气压力是5000个大气压。也就是说,这时候的压力比1163倍大多了。这是因为,当压力不太大的时候,前面的比例关系是成立的,但是在压力比较大的时候,这个关系就不成立了。比如说,在化学工厂中,1吨氮气在正常气压下的体积是800立方米,而在1000个大气压下,它的体积是1.7立方米;如果气压增大到5000个,体积是1.1立方米。
